|
Национальный
|
Инструкция по бактериологической диагностике туберкулезной инфекции
Об институте:
лечебно-диагностическая работа,
Новости:
Наши издания:
"Украинский
пульмонологический журнал" (УПЖ),
"Украинский
химиотерапевтический журнал" (УХЖ),
"Астма и аллергия"
Оригинальные статьи:
оригинальные научные статьи, ранее нигде не публиковавшиеся
Нововведения:
методические рекомендации,
информационные письма,
ведомственные
инструкции,
нововведения,
монографии
Патенты:
патенты и авторские свидетельства института
Отчеты о НИР:
рефераты законченных научно-исследовательских работ
Подготовка кадров:
клиническая ординатура,
курсы информации и
стажировки,
в помощь аспиранту и соискателю
Научные форумы:
резолюции и обращения съездов, конференций, совещаний...
Информация для специалистов:
Информация для населения:
полезная информация о заболеваниях легких, их профилактике и лечении
Асоциация фтизиатров и пульмонологов Украины:
4.4 Генодіагностика: визначення наявності ДНК M.tuberculosis і M.bovis у діагностичному матеріалі від хворих на туберкульоз за допомогою полімеразної ланцюгової реакції (ПЛР)
В ряду сучасних генетичних технологій метод полімеразної ланцюгової реакції (ПЛР) займає особливе місце. Метод ПЛР піднімає генодіагностику на принципово інший рівень - рівень визначення ДНК чи РНК, що дозволяє провести пряме виявлення інфекційного агента, або генетичної мутації. За допомогою ПЛР одна молекула ДНК певного інфекційного агента може бути виявлена в присутності мільйонів інших молекул ДНК. Особливо ефективним виявилося застосування методу в медицині, де в останній час використовується велика кількість різних комерційних наборів для ПЛР-діагностики. Особливо наочні переваги методу для діагностики позалегеневих форм туберкульозу та визначення резистентності M.tuberculosis до антимікобактеріальних препаратів.
Принцип.
Полімеразна ланцюгова реакція (ПЛР) - це метод ампліфікації in vitro, за допомогою якого протягом декількох годин можна виділити і розмножити визначену послідовність ДНК у кількості, що перевищує вихідну в мільйони разів. ПЛР - це процес, що протікає в одній пробірці та складається з повторних циклів ампліфікації (розмноження, копіювання) специфічної послідовності молекули ДНК із метою одержання достатньо великої кількості копій, що можуть бути виявлені звичайними методами детекції.
Одним із ключових компонентів реакції є "праймери" - синтетичні олігонуклеотиди, що складаються з 15-30 основ, комплементарних "сайтам" (ділянкам) відпалення (приєднання) на матричній ДНК, що ідентифікується. Процес підбору ефективних праймерів для ПЛР включає дизайн, синтез, перевірку якості синтезованих праймерів, а також аналітичну і клінічну чутливість і специфічність ПЛР. Праймери підбираються на консервативні ділянки ДНК інфекційного агента таким чином, щоб забезпечити ампліфікацію тільки обраного специфічного фрагмента.
Кожен цикл ПЛР складається з трьох стадій, що протікають при різних температурах: денатурації, відпалення та подовження. Під час 1-ої стадії - денатурації - відбувається плавлення ДНК при температурі 95 град. Цельсію, при цьому нитки ДНК роз'єднуються та стають доступними для праймерів. При відпаленні ("anneling") реакційна суміш охолоджується до температури, що є оптимальною для приєднання "праймерів" до нитки ДНК. Подовження починається від праймерів і каталізується ферментом ДНК-полімеразою при оптимумі температури 72 град. Цельсію.
Полімеразна ланцюгова реакція протікає автоматично в програмованому термостаті- термоциклері (ампліфікаторі). Трьохступінчатий цикл, у результаті якого виходять точні копії ділянки матричної ДНК, що ідентифікується, повторюється 30-50 разів відповідно до заданої програми термоциклера. З кожним новим циклом число молекул матричної ДНК подвоюється, тобто кількість копій наростає в геометричній прогресії.
Хід дослідження.
Виявлення збудників туберкульозу в клінічних ізолятах методом ПЛР може бути виконано за допомогою "Набору реактивів для виявлення дезоксирибонуклеїнової кислоти M.tuberculosis, М.bovis ("MYC - TEST"), що складається з трьох комплектів: N 1 - для виділення ДНК із клінічного матеріалу, N 2 - для ампліфікації ДНК M.tuberculosis, М.bovis, N 3 - для поділу ДНК методом електрофорезу в гелі агарози.
Набір MYC - TEST забезпечує ампліфікацію фрагмента інсерційного елемента IS 6110 хромосоми M.tuberculosis, М.bovis і дозволяє знайти 50 клітин мікобактерій.
Процедури підготовки проб та аналізу матеріалу прості у виконанні, не вимагають дорогого обладнання, що робить можливим застосування методу ПЛР для ідентифікації комплексу M.tuberculosis, М.bovis на базі обласних протитуберкульозних диспансерів у найближчі часи.
Використання методу підрощуваня при дослідженні харкотиння на рідкому живильному середовищі у системі MGIT з наступним добором проб і визначенням у них ДНК M.tuberculosis/bovis методом ПЛР, істотно підвищує чутливість діагностичного методу та надає йому додаткові переваги в порівнянні з традиційними культуральними методами.
Процедура аналізу клінічного матеріалу складається з 3-х етапів.
1 етап - відбір і попередня обробка досліджуваного матеріалу для характеристики ДНК методом ПЛР
Відбір та підготовка клінічного матеріалу для аналізу.
Клінічний матеріал - зразки культур, харкотиння, кров, сечу відбирають лише одноразовими інструментами та в одноразові пластикові пробірки або контейнери з кришкою, кров збирають у пробірку з консервантом (1/10 об'єму 3,0 % ЕДТА або 4,0 % цитрату натрію).
Відібрані зразки пакують у окремі пакети, щоб уникнути контамінації і доставляють у лабораторію у ізотермічному контейнері з охолоджувачем або льодом при температурі нижчій 0 град. Цельсію, протягом доби. Відібрані зразки зберігають при температурі +4,0 град. Цельсію не більше доби, а при -20,0 град. Цельсію не більше 1 місяця. Допускається одноразове заморожування та розморожування матеріалу. Кров не заморожують і зберігають при температурі +4,0 град. Цельсію не більше 1 доби до проведення дослідження.
Попередня обробка матеріалу.
Культура мікроорганізмів. 100,0 мкл суспензії зразка культури мікроорганізмів внести в пробірку ємністю 1,5 куб. см і використовувати для виділення ДНК.
Харкотиння.
До 500,0 мкл харкотиння додають 500,0 мкл спутолізина і залишають при кімнатній температурі на 30 хвилин. Центрифугують при 10 000 об/хв 5 хвилин. Надосадну рідину видаляють.
Сеча.
1 куб. см сечі помістити в пробірку, центрифугувати при 10 000 об/хв. протягом 5 хвилин. Надосадову рідину обережно видалити, залишаючи над осадом 100,0 мкл рідини. Якщо осаду практично не видно, тоді в цю ж пробірку додати ще 1 куб. см сечі та повторити процедуру центрифугування. Розчинити осад у рідині, що залишилася в пробірці та використовувати цю завись для виділення ДНК.
Кров.
Для виділення ДНК використовують 100,0 мкл суцільної консервованої крові. Як консервант (антикоагулянт) використовують 3,0 % ЕДТА або 4,0 % цитрат натрію в кількості 10,0 % до об'єму крові.
Примітка.
При використанні деяких наборів можуть бути передбачені спеціальні рекомендації по підготовці матеріалу для дослідження. У цьому випадку потрібно керуватися інструкцією, що додається до даного набору.
Виділення ДНК із клінічного матеріалу може проводитись за допомогою набору реактивів N 1 із набору MYC - TEST.
Порядок проведення робіт.
1. До осаду підготовленого матеріалу додати 400,0 мкл "Буфера ЛБФ і прогріти в термостаті при температурі 100 град. Цельсію на протязі 15 хвилин (кришки пробірок повинні бути щільно закритими) та охолодити при кімнатній температурі.
2. Додати в пробірки по 10,0 мкл старанно перемішаного до однорідної зависі магнітного сорбенту та перемішати.
3. Витримати 10 хвилин при кімнатній температурі, періодично (2-3 рази), струшуючи пробірку.
4. Помістити сорбент у магнітний штатив для осадження сорбенту на стінці пробірки. При відсутності магнітного штатива - осадити сорбент центрифугуванням 15 - 20 секунд при 1500 - 2000 об/хв. Надосадну рідину видалити піпеткою зі змінним наконечником.
5. До осаду в пробірці додати 300,0 мкл "Буфера ПБ 1", струсити на центрифузі-вортексі протягом 5 - 10 секунд до гомогенного стану зависі та помістити пробірку в магнітний штатив для осадження магнітного сорбенту. Надосадну рідину видалити піпеткою зі змінним наконечником.
6. До осаду в пробірці додати 500,0 мкл "Буфера ПБ 2" струсити на вортексі протягом 5 - 10 секунд до гомогенного стану та помістити пробірку в магнітний штатив для осадження магнітного сорбенту. Надосадну рідину видалити піпеткою зі змінним наконечником.
7. Повторити операцію 6. Звернути увагу на повне видалення надосадної рідини та уникати відсмоктування часток магнітного сорбенту.
8. Помістити пробірки в термостат при температурі 65 град. Цельсію на 10 хвилин, залишаючи пробірки відкритими для випаровування залишкової кількості промивної рідини.
9. Додати до осаду 30,0 мкл "Буфера ТЕ", пробірки закрити, струсити на вортексі протягом 10 секунд та інкубувати в термостаті при темпратурі 65 град. Цельсію протягом 5 хвилин.
10. Пробірки струсити на вортексі протягом 10 секунд і помістити в магнітний штатив для осадження сорбенту. Відібрати для аналізу надосадну рідину, що містить виділену ДНК. Зберігати виділену ДНК при температурі -20 град. Цельсію або -70 град. Цельсію.
Умови проведення робіт.
Не допускається повторного використання пробірок і наконечників. При проведенні робіт слід використовувати одноразові рукавички, маски й халати.
Форма випуску та пакування.
Компоненти набору, кількість пробірок, їх вміст і маркерування наведені в табл.4.2.
| № | Найменування компонентів (напис на етикетці) | Номінальний об'єм в упаковці (куб. см) | Вид пакування | К-сть штук |
| 1 | Буфер ЛБ | 30 | Пластикова пробірка ємністю 50 куб. см | 1 |
| 2 | Буфер ПБ 1 | 30 | Пластикова пробірка ємністю 50 куб. см | 1 |
| 3 | Буфер ПБ 2 | 50 | Пластикова пробірка ємністю 50 куб. см | 2 |
| 4 | Буфер ТЕ | 2 | Пластикова пробірка ємністю 2 куб. см | 1 |
| 5 | Сорбент | 1,1 | Пластикова пробірка ємністю 2 куб. см | 1 |
2 етап - власне полімеразна ланцюгова реакція. Здійснюється за допомогою комплекту N 2, який використовується для аплікації ДНК M.tuberilosis, M.bovis у пробах, що аналізуються, і отримані після виділення ДНК
Порядок проведення робіт.
1. Підпишіть і розставте в штатив необхідну кількість (що відповідає числу проб, котрі аналізуються) пробірок майстер-мікс і пробірок позитивного (К +) та негативного (К -) контролів.
2. Додайте в кожну пробірку по 20,0 мкл плр - буфера. Закрийте пробірки та залишіть їх у штативі при кімнатній температурі на 10 - 15 хвилин.
3. Струсіть кожну пробірку на вортексі або центрифузі-вортексі протягом 10 - 20 секунд до повного розчинення кольорового осаду.
4. Внесіть у пробірки для проб по 5,0 мкл відповідного матеріалу, що аналізується. В контролі (пробірки К + і К - і додайте по 5,0 мкл дейонізованої води.
5. Закрийте пробірки та перемішайте їх вміст на вортексі або центрифузі-вортексі протягом 5 сек. Примітка. При наявності крапель рідини на стінках пробірки, помістіть пробірки в центрифугу-вортекс і центрифугуйте їх при 1500 - 2000 об/хв. Протягом 5 хвилин.
6. Додайте в кожну пробірку по 30,0 - 40,0 мкл мінерального масла (1 краплю).
7. Закрийте пробірки, розмістіть їх у термоциклер (ампліфікатор) і запустіть програму ампліфікації (табл.4.3).
Таблиця 4.3 - програма ампліфікації
| Етапи апмпліфікації | Температура (град. Цельс.) | Час (хв.) | Кількість циклів |
| 1 | 95 | 5 | 1 |
| 2 | 94 | 1 | - |
| 65 | 1 | 5 | |
| 74 | 1 | - | |
| 3 | 94 | 0.5 | - |
| 65 | 0.5 | - | |
| 73 | 0.5 | - | |
| 4 | 72 | 5 | 1 |
| 5 | - | Зберігання | - |
Умови проведення робіт.
Роботи з набором повинні проводитись у спеціалізованій лабораторії з дотриманням загальних і спеціальних вимог роботи на обладнанні, що використовується. Не допускається повторного використання пробірок і наконечників. При проведенні робіт слід використовувати одноразові рукавички, маски й халати.
Для якісного проведення реакції ампліфікації (забезпечення необхідної чутливості, специфічності й відтворюваності) рекомендується використання ампліфікаторів (термостатів програмних) з наступними основними парметрами:
- швидкість нагрівання не менш, ніж 2,0 град. Цельсію за секунду, в діапазоні 40-97 град. Цельсію - швидкість охолоджування не менш, ніж 2,0 град. Цельсію за секунду, в діапазоні 50-97 град. Цельсію; об'єм пробірок - 0,5 - 0,6 куб. см.
Таким параметрам на цей час відповідають ампліфікатори виробництва країн СНД - тільки МС-2 "Терцик" (Росія), інших країн - типу "Mastercecler 5330 plus" (Eppendorf, Німеччина), "Progen" (Techne, Великобританія) або аналог.
Форма випуску й пакування.
Комплектність набору для ампліфікації ДНКднк M.tuberculosis, M.bovis наведена в табл.4.4.
Таблиця 4.4 - комплектність набору для ампліфікації ДНК M.tuberculosis, M.bovis
| № | Найменування компонентів в упаковці (напис на етикетці) | Номінальний об'єм (куб. см) | Вид пакування | К-сть штук |
| 1 | Плр - буфер | 1 | Пластикова пробірка ємністю 2 куб. см | 2 |
| 2 | ПробіркиМайстер-Мікс
(маркування кольором) |
Суха суміш | Блакитна пластикова пробірка ємністю 0,5 куб.см | 100 |
| 3 | Масло мінеральне (Мін. масло) | 2 | Пластикова пробірка ємністю 2 куб. см | 2 |
| 4 | Вода дейонізована (дд-вода) | 2 | Пластикова пробірка ємністю 5 куб. см | 1 |
| 5 | Позитивний контроль (К +) | Суха суміш | Червона пластикова пробірка ємністю 0,5 куб.см | 5 |
| 6 | Негативний контроль (К - ) | Суха суміш | Безбарвна пластикова пробірка ємністю 0,5 куб.см | 5 |
3 этап - детекція продуктів ампліфікації за допомогою гельелектрофорезу
Порядок проведення робіт.
1. Приготування буферного розчину для електорофорезу (БЕ). Розчинити вміст пакета з написом "Буфер для електрофорезу" в 200 куб. см дистильованої води й довести об'єм розчину до 1 л. Після приготування зберігати розчин при температурі плюс 4,0 град. Цельсію.
2. Приготування гелю агарози. В конічну термостійку колбу, ємністю 250 куб. см внести вміст одного пакета з агарозою, додати 200 куб. см БЕ та помістити колбу на електричну плитку. Довести вміст колби до кипіння і через 10 - 20 хвилин, після того як агароза повністю розчиниться, колбу з розплавленою агарозою зняти з плитки. Розчин агарози, що отримали, повинен бути прозорим і не повинен містити окремих нерозплавлених часток.
3. Підготовка електрофоретичної камери до заливання гелю агарози. Встановити кришку з ванночкою на камеру, а платформу для заливання гелю помістити у ванночку. Встановити гребінчик (можна встановити 2 і навіть 4 гребінчики залежно від кількості проб, що аналізуються) на платформу.
4. В колбу з розчином агарози внести 5,0 мкл етідіума броміду, старанно й обережно перемішати вміст колби рівномірними обертовими рухами. Після цього розплавлену агарозу охолодити до 50 град. Цельсію при кімнатній температурі.
5. Охолоджену до 50 град. Цельсію агарозу вилити на платформу. Товщина шару агарози повинна бути не меншою за 4 мм.
6. Після застигання гелю агарози (приблизно через 25 - 30 хвилин) обережно витягнути гребінчик, не пошкодивши при цьому карманів, платформу з агарозним гелем перенести з ванночки в електрофоретичну камеру.
7. Залити 800 куб. см розчину БЕ в електрофоретичну камеру так, щоб він вкривав агарозний гель шаром 5 - 6 мм.
8. Додати в пробірку з "Контрольним зразком ДНК" 50,0 мкл бідистильованої води. Перемішати вміст до повного розчинення осаду. Додати в розчин 10,0 мкл фарби-лідера. Внести рекомендовану кількість фарби-лідера в проби, що аналізуються, та перемішати. Внести в одну лунку з гелем під шар БЕ 5,0 мкл приготованого "Контрольного зразка ДНК" і в інші по 5,0 - 20,0 мкл проб, що аналізуються, з попередньо внесеною фарбою-лідером так, щоб вміст заповненого пробою карману не перетікав у інший.
9. Проведення електрофорезу. Встановити кришку на камеру, підключити електрофоретичну камеру до джерела живлення, встановити на джерелі живлення напругу в 200 V (не більш 15 V/см). Через 25 - 35 хвилин електрофоретичну камеру відключити від джерела живлення, від'єднати дроти та тільки після цього зняти кришку з електрофоретичної камери. Дістати платформу з гелем з електрофоретичної камери, дати рідині стекти й обережно промити гель дистильованою водою. Примітка. При роботі з гелем агарози при додаванні етідіуму бромідіу і подальшому дослідженні, слід обов'язково надягати гумові рукавички!
10. Облік результатів.
Після проведення електрофорезу гель агарози виймають з приладу для електрофорезу, продивляються або (і) фотографують на фотоплівку типу "Мікрат 300" або "Ізопан" в ультрафіолетовому світлі з довжиною хвилі 254 або 310 нм з використанням флуоскопа. Продукт ампліфікації на фотоплівці видно у вигляді темної смужки. Допускається використання інших методів аналізу електрофореграм (використання цифрових або телекамер, сканування гелю).
Особливістю тест-системи, що пропонується, є наявність у "ПЛР-пробірках" ДНК внутрішнього стандарту (ВС). ВС дозволяє контролювати проходження реакції у кожній пробірці, яка утримує ДНК досліджуваного зразка, що виключає отримання помилково-негативних результатів аналізу.
Чутливість визначення - 50 геном/екв.
Розмір амплікона мішені - 229 н.п.
Розмір амплікона ВС - 335 н.п.
Можливі варіанти електрофорезу продуктів ампліфікації
наведені на рис. 4.1.
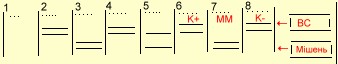
Рис. 4.1 - Можливі варіанти електрофорезу продуктів
ампліфікації
Примітки:
1. 1 - 5 - клінічні зразки;
2. 6 - 7 - позитивний контроль;
3. 8 - негативний контроль;
4. ![]() - смужка в гелі, що відповідає розміру
амплікона внутрішнього стандарту;
- смужка в гелі, що відповідає розміру
амплікона внутрішнього стандарту;
5. ![]() -
смужка в гелі, що відповідає ділянці ДНК
M. tuberculossis, М. bovis, яка ампліфікується.
-
смужка в гелі, що відповідає ділянці ДНК
M. tuberculossis, М. bovis, яка ампліфікується.
На рисунку 4.1 в колонці 1 смужки ампліконів відсутні. Це означає, що реакція не пройшла і аналіз необхідно повторити.
В колонці 2 видно тільки смужку ВС. Це означає, що результат негативний (у досліджуваному зразку ДНК M. tuberculosis, М. bovis відсутня або її кількість менша, ніж 50 геном/екв у 5,0 мкл розчину виділюваної ДНК).
В колонці 3 видно тільки смужку амплікона мішені - результат позитивний. ВС пригнічений великою кількістю мішеней.
В колонці 4 видно смужки ампліконів ВС та мішені. Це означає, що реакція позитивна (в 5,0 мкл розчину виділеної ДНК знаходиться 50-1000 геном/екв мікобактерій). Співвідношення інтенсивності смужок може бути різним.
В колонці 5 видно слабке світіння смужок амплікона мішені та ВС. Це свідчить, що, можливо, в реакції присутній інгібітор. Необхідно повторити аналіз.
В колонці 6 - позитивний контроль реакції (К+) пройшов нормально і вказує на те, що в пробі присутня невелика кількість мішені.
В колонці 7 - контроль пробірок Майстер-Мікс (ММ). Позитивний контроль реакції пройшов нормально.
В колонці 8 присутня тільки смужка ВС, це означає, що негативний контроль реакції (КЦ) пройшов нормально *.
* Примітка.
Якщо негативний контроль проходить за варіантами 6 або 7, то необхідно з'ясувати джерело контамінації та повторити аналіз.
Форма випуску й пакування.
Компоненти набору, кількість пробірок, їх вміст і маркерування наведені в табл.4.5.
Таблиця 4.5 - Комплектність набору для поділу ДНК методом електрофорезу в гелі агарози
| Найменування компонентів в упаковці (напис на етикетці) | Номінальна кількість | Вид пакування | К-сть штук |
| Етідіума бромід | 30,0 мкл | Пластикова пробірка 2 куб. см | 1 |
| Фарба-лідер | 500,0 мкл | Пластикова пробірка 2 куб. см | 1 |
| Буфер для електрофорезу | 18,0 г | Пластиковий пакет (флакон 20 куб. см) | 1 |
| Агароза | 4,0 г | Пластиковий пакет (флакон 20 куб. см) | 2 |
Матеріали, обладнання:
ь термостат (ампліфікатор) програмний типу МС-2 "Терцик" (Росія), Mastercecler 5330 plus (Eppendorf, Німеччина; Techne, Великобританія) або аналог;
ь термостат для мікропробірок, що підтримує температуру (65 + - 2) град. Цельсію типу Dri-block-BLD-701-010X (фірма Techne, Великобританія) або аналог;
ь мікроцентрифуга, що розвиває прискорення 14 000 об/хв., типу А 14 (JOUAN S.A., Франція, кат. N 11174542) або аналог;
ь вихровий змішувач типу Вортекс CV-1500 (Росія) або аналог;
ь електрофоретична камера типу SE-1, SE-2 (Росія) або аналог;
ь джерело постійного струму типу ЭЛЬФ 4, ЭЛЬФ 8 (Росія) або аналог;
ь трансілюмінатор ультрафіолетовий типу Т-16-365 (Росія) або аналог;
ь холодильник побутовий;
ь піпетки напівавтоматичні одноканальні зі змінними наконечниками з перемінним або фіксованим об'ємом, що дозволяють відбирати об'єми рідини 5, 15, 20, 80 мкл, атестовані за значенням середньої дози й східністю результатів піпетування (похибка не більше + - 3,0 %);
ь мікрохвильова піч;
ь плитка електрична;
ь мікропробірки ампліфікаційні ємністю 0,5 куб. см (Кат. N 00301210023, фірма Eppen-dorf, Німеччина) або аналог;
ь колба конічна ємністю 250 куб. см за ДСТ 25336;
ь колба конічна ємністю 1000 куб. см за ДСТ 25336;
ь колба конічна ємністю 500 куб. см за ДСТ 25336;
ь папір фільтрувальний лабораторний за ДСТ 12026;
ь рукавички гумові хірургічні за ДСТ 3-88;
ь спирт етиловий ректифікований за ДСТ 5962;
ь штатив магнітний; штатив для мікропіпеток.
Необхідно пам'ятати, що існують набори для виявлення МБТ і інших фірм, тому можливо використання наборів реагентів для виявлення МБТ за допомогою ПЛР і інших фірм, зареєстрованих в Україні відповідним чином.